近日🌒,我院史向陽教授課題組製備了一種具有光觸發團聚的超小鐵診斷平臺,該平臺具有光響應精準可調的r1和r2弛豫率以及可轉換的T1/T2 MR成像性能⛹🏿♂️,可用於增強滯留和靶向關節炎的雙模態MR成像。相關成果以《光觸發超小氧化鐵納米團簇用於關節炎的增強和動態MR成像》(Light-Addressable Nanoclusters of Ultrasmall Iron Oxide Nanoparticles for Enhanced and Dynamic Magnetic Resonance Imaging of Arthritis, DOI: 10.1002/advs.201901800)為題發表在國際著名期刊《Advanced Science》上。我校系論文第一完成單位,沐鸣碩士李鑫(現為亞琛工業大學博士生)、陸詩怡為共同第一作者🪴🧛🏻♀️,史向陽教授😔、沈明武研究員和同濟大學附屬第十人民醫院彭琛副研究員為並列通訊作者。
炎症性關節炎是最常見的影響人類健康的疾病之一🍋🟩,因為其發病率高,50歲以上患者的致殘率達50%。目前🍾,高分辨率的無創MR成像被認為是早期診斷關節炎的有效技術。為了進一步提高診斷的靈敏度和準確度,一般會將多種成像元素復合到一個功能化造影劑中以實現雙/多模態成像診斷。對於雙模態T1/T2 MR成像,通常將T1造影劑(釓或錳基納米顆粒)和T2造影劑(超順磁氧化鐵納米顆粒)整合成一個單納米系統👩🏽🚒。然而,這類通過將兩種功能元素簡單組合的策略得到的結果往往是無法令人滿意的,這是由於這類納米系統存在膠體不穩定性👲🏿、元素成分依賴的r1/r2比和進一步表面功能化等問題。此外🍩,開發基於同一元素納米平臺用於可調的轉換或共存T1/T2 MR成像也是十分困難的♛。
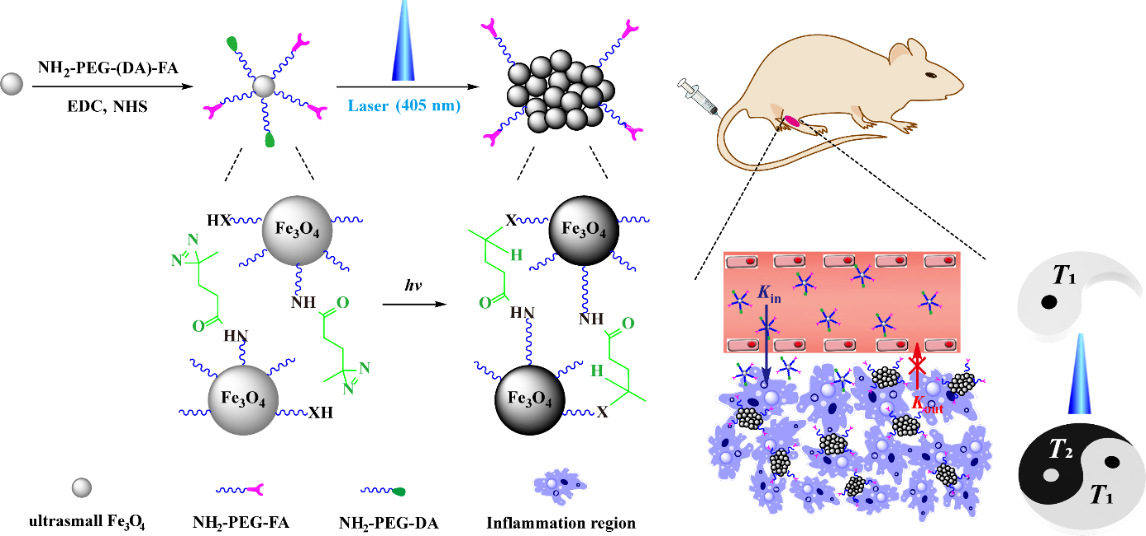
(Fe3O4-PEG-(DA)-FA NPs的合成及用於關節炎增強滯留和靶向雙模態T1/T2 MR成像)
針對上述技術難點,在本項研究工作中,研究團隊構建了具有光觸發組裝的超小鐵團簇用於關節炎的增強靶向和動態T1/T2 MR成像。主要設計思路如下:利用水熱合成法製備具有較高r1弛豫率的超小氧化鐵納米顆粒😞,之後修飾上聚乙二醇化的光響應分子(PEG-DA)和聚乙二醇化的靶向分子(PEG-FA)🧑🤝🧑,得到的納米平臺能在405nm 激光照射下交聯團聚🛀🏿,並獲得具有精準可調r1和r2弛豫率的超小鐵團簇;經靜脈註射超小鐵納米顆粒後,超小尺寸使其能更容易在關節炎周圍血管中滲出進入炎症區🤷🏼,靶向分子使其能更容易在炎症區聚集,實現關節炎處的增強T1 MR成像🦨;之後在激光照射下能引發超小鐵納米顆粒交聯成團簇,從而阻止團簇再進入血液循環👨👨👧👦,實現其在關節炎處的分級靶向聚集🧘🏻♀️,達到增強滯留的雙模態T1/T2 MR成像。結合光觸發組裝和分級靶向策略可使得納米平臺有效的繞過大部分生物障礙和增強其在目標區域的滯留,該策略對絕大多數疾病具有普適性,不受特定生物環境因素限製⬇️👮🏽,因為大多數疾病(如炎症、腫瘤等)都可利用光控製實現時空上操作的統一🈹。
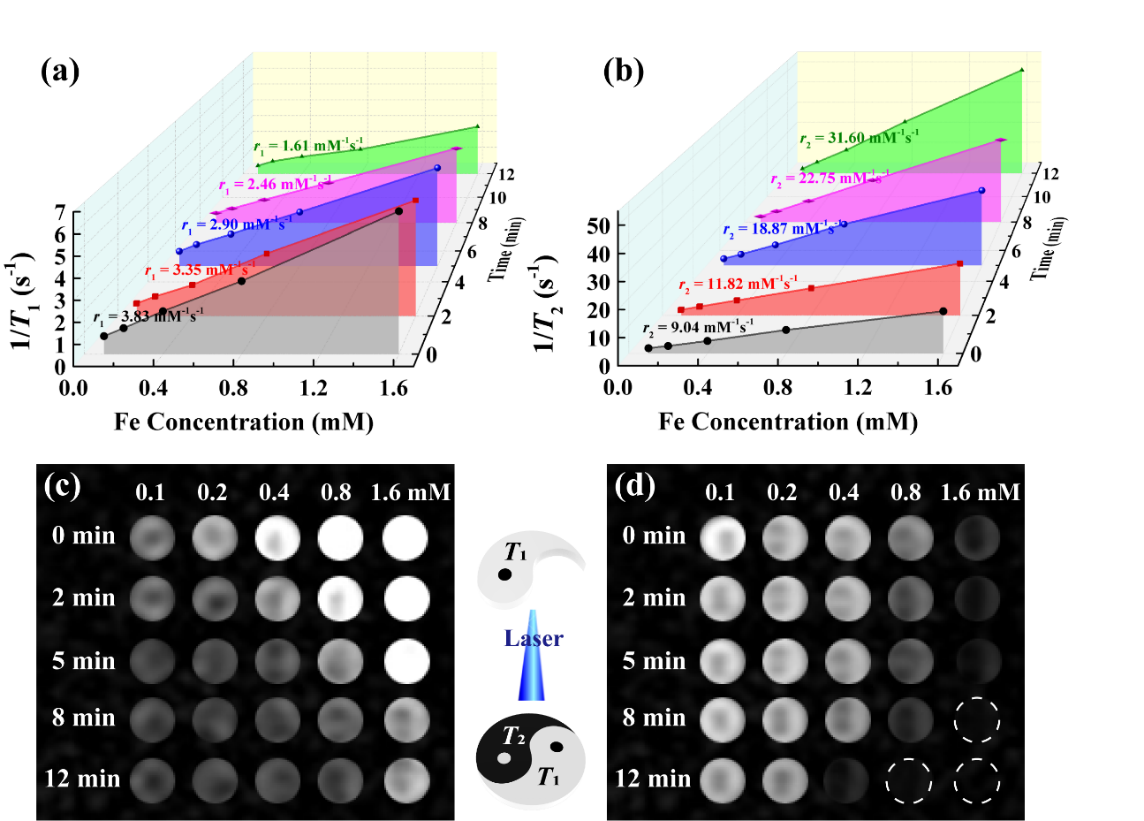
(激光照射不同時間後形成的超小鐵團簇的r1/r2弛豫率及其相應的>T1/T2 MR成像)
超小鐵納米顆粒經靜脈註射後👩🏽,具有優異的FA介導靶向關節炎的T1 MR成像。經激光照射12 min後形成的團簇在關節炎處具有增強的雙模態T1/T2 MR成像,並且經激光照射後形成的團簇能進一步增強其在關節炎處的滯留🛫,從而提高關節炎診斷的精準度🦹♂️。本研究設計的光觸發團聚的超小鐵診斷平臺可用於多種疾病的動態和增強的雙模態T1/T2 MR成像👘,並具有高的診斷精準性。該研究將為利用光觸發組裝和分級靶向策略設計功能化平臺來實現疾病精準診療提供新的思路🧑🧑🧒。
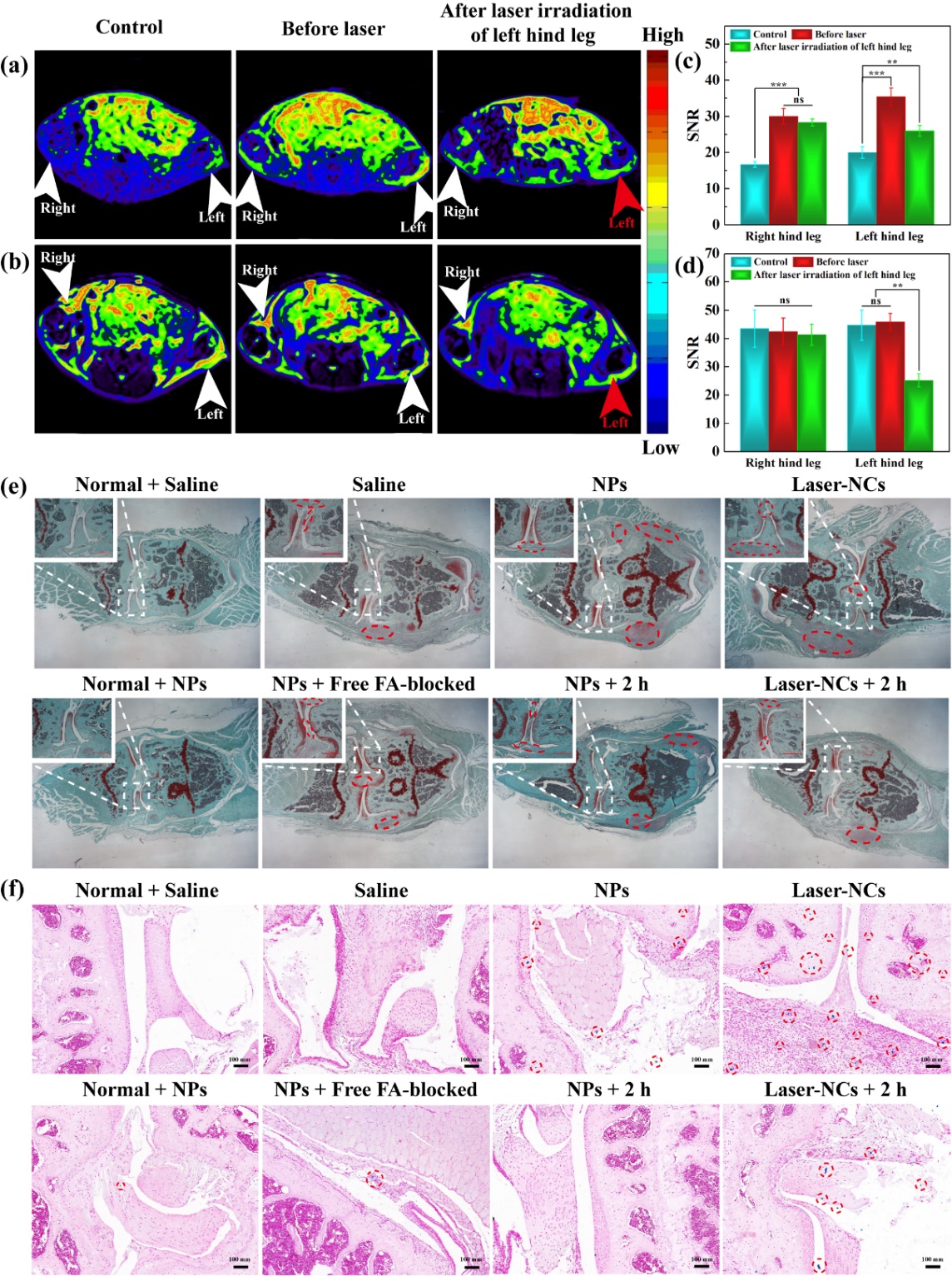
(激光照射後超小鐵團簇在裸鼠關節炎處的靶向雙模態T1/T2 MR成像和增強滯留)
近年來史向陽教授課題組還相繼開發了多種超小鐵基納米平臺用於增強的腫瘤診療應用,並發表一系列研究論文(Nanoscale,2015,7,14538;Adv.Sci.,2018,5,1801612; Nanoscale, 2019,11,4904; J.Mater.Chem.B,2019,7,368.)。
該工作得到了國家自然科學基金A3前瞻計劃國際合作項目、中德中心項目,上海市科委項目和中央高校基本科研業務費專項資金等項目資助。
論文鏈接:https://doi.org/10.1002/advs.201901800
沐鸣平台化學化工與生物工程沐鸣

